为了制定或修订现有法规(Regulation),FDA 会在《联邦公报》上发布拟议规则(Proposed rule)并征询意见。FDA 将评估收到的所有意见(Comments),并发布最终规则(Final rule)。拟议规则一旦最终确定,就会在《联邦法规汇编》CFR(Code of Federal Regulations)中公布。
FDA 法规条例(FDA Rules and Regulations)
根据法律规定,美国食品药品监督管理局 FDA 在《联邦公报》(Federal Register)上发布法规(Regulations),《联邦公报》FR(Federal Register)是美国联邦政府的官方每日刊物(Official daily publication),用于向公众通报各类机构行动(Agency actions),刊登规则、拟议规则和通知,以及行政命令和其他总统文件。联邦法规(Federal regulations)或由法律强制要求,或经法律授权制定。有些法规,例如美国食品药品监督管理局 FDA 的鸡蛋安全法规,旨在解决特定问题或已知的健康危害;而另一些法规,例如公民请愿法规,则属于行政性或程序性法规。
FDA 遵循的规则制定程序(Rulemaking procedures)源自美国法律、总统发布的行政命令 EO(Executive Orders)和备忘录(Memoranda),以及 FDA 自身的规章(FDA’s own regulations)。
公告和评论规则制定(Notice and Comment Rulemaking)
FDA 最常用的规则(Rules)制定流程通常称为“公告和评论规则制定”(Notice and Comment Rulemaking)。该流程的第一步是发布拟议规则(Proposed rule)(也称为“拟议规则制定通知”或“NPRM”)(Notice of proposed rulemaking)。拟议规则会阐明 FDA 拟要求或拟采取的措施及其依据(如科学依据和政策考量),并征求公众意见。意见(Comments)一般通过美国联邦政府的电子案卷网站(Electronic docket site)提交,网址为 Regulations.gov。
如果 FDA 需要更多信息或尚未确定监管路径(Regulatory path)的具体细节,有时会发布征询意见稿(Request for comments)拟议规则制定预先通知 ANPRM(Advance notice of proposed rulemaking)。这类《联邦公报》通知旨在就广泛的议题或问题征集公众意见,并收集数据或其他信息。FDA 会利用公众意见提供的信息来协助其制定后续拟议规则中将要提出的具体政策。
在发布拟议规则并收到和审查公众意见(Public comments)后,FDA 将决定是否需要采取进一步行动。根据收到的公众意见,FDA 可能会决定终止规则制定程序(Rulemaking process)、发布新的拟议规则或发布最终规则(Final rule)。如果 FDA 决定发布最终规则,则将在《联邦公报》上公布该规则。最终规则将阐明监管要求(也称为“成文”部分)("Codified" portion)、这些要求对行业或公众的影响,并回应公众对拟议规则的意见。这些监管要求(Regulatory requirements)或最终规则的成文部分(Codified portion)也将在《联邦法规汇编》第 21 编(Title 21 of Code of Federal Regulations)中公布。
拟议规则与最终规则的审查(Review of Proposed and Final Rules)
在 FDA 拟议规则或最终规则完成后,但尚未在《联邦公报》上公布之前,
美国联邦政府的其他部门可能会对其进行审查(Reviewed)。例如,FDA 隶属于美国卫生与公众服务部 HHS(Department of Health and Human Services),因此 HHS 部长办公室(Office of the Secretary of HHS)或其他 HHS 下属机构可能会在规则草案公布前对其进行审查。此外,在制定影响范围更广的规则时,FDA 也可能会咨询非 HHS 机构(Non-HHS agencies)的意见。
根据第 12866 号行政命令(Executive Order 12866),如果拟议规则或最终规则被认定为“重大”(Significant),则白宫管理和预算办公室 OMB 下属的信息和监管事务办公室 OIRA(Office of Management and Budget’s Office of Information and Regulatory Affairs)必须对其进行审查,并与其他对此问题感兴趣的联邦机构协调审查工作。在这种情况下,FDA 将与 OIRA 合作以获得相应的批准(Obtain appropriate clearances)。
联邦法规汇编第 21 编:食品和药品(Code of Federal Regulations - Title 21 - Food and Drugs)
《联邦法规汇编》CFR(Code of Federal Regulations)是对美国联邦政府行政部门和机构在《联邦公报》(Federal Register)上发布的一般性和永久性规则(General and permanent rules)的编纂(Codification)。
CFR 第 21 编(Title 21 of the CFR)(Parts 1-1271)是专门用于美国食品药品监督管理局 FDA 的规则。CFR 的每一篇(或卷)(Title or volume)每年修订一次,修订后的第 21 编(Revised title 21)大约在每年 4 月 1 日发布。
《联邦食品、药品和化妆品法案》(FD&C Act)
1906 年的《纯净食品药品法案》(The Pure Food and Drug Act of 1906)是美国公共卫生和消费者保护体系之一的 200 余部法律中的第一部。
《联邦食品、药品和化妆品法案》(FD&C)(Federal Food, Drug, and Cosmetic Act)是美国国会于 1938 年通过的一系列法律,授权美国食品药品监督管理局 FDA 监管食品、药品、医疗器械和化妆品的安全。FD&C 法案是 FDA 的主要授权立法,自颁布生效至今,该法案已被多次修订。
FD&C 法案的出台源于 100 多名患者因服用磺胺酏剂(Elixir sulfanilamide)而死亡的事件。这种磺胺类药物(Sulfanilamide medication)在配制过程中使用了有毒溶剂二甘醇(Toxic solvent diethylene glycol)来溶解药物,使其呈液态。该法案彻底改革了美国公共卫生体系(Public health system),取代了 1906 年的《纯净食品药品法案》(Pure Food and Drug Act of 1906)。除其他条款(Provisions)外,该法案授权美国食品药品监督管理局 FDA 要求新药提供安全性证明、制定食品标准并进行工厂检查(Conduct factory inspections)。
《联邦食品、药品和化妆品法案》部分修正案(Selected Amendments to the FD&C Act)
-
1980 年婴儿配方奶粉法案:
Infant Formula Act of 1980 (Public Law (PL) 96-359)(1980 年 10 月 26 日) -
1983 年孤儿药法案:
Orphan Drug Act (PL 97-414)(1983 年 1 月 4 日) -
1984 年药品价格竞争和专利期限恢复法案 :
Drug Price Competition and Patent Term Restoration Act of 1984(PL 98-417)(1984 年 9 月 24 日) -
1987 年处方药营销法案:
Prescription Drug Marketing Act of 1987 (PL 100-293)(1988 年 4 月 22 日) -
1988 年通用动物药品与专利期限恢复法案:
Generic Animal Drug and Patent Term Restoration Act of 1988(PL 100-670)(1988 年 11 月 16 日) -
1990 年营养标签和教育法案:
Nutrition Labeling and Education Act of 1990(PL 101-535)(1990 年 11 月 8 日) -
1990 年安全医疗器械法案:
Safe Medical Devices Act of 1990(PL 101-629)(1990 年 11 月 28 日) -
1992 年医疗器械修正案:
Medical Device Amendments of 1992(PL 102-300)(1992 年 6 月 16 日) -
1992 年处方药修正法案 & 1992 年处方药用户费用法案:
Prescription Drug Amendments of 1992;Prescription Drug User Fee Act of 1992(PL 102-571)(1992 年 10 月 29 日) -
1994 年动物药品使用澄清法案(AMDUCA):
Animal Medicinal Drug Use Clarification Act of 1994 (PL 103-396)(1994 年 10 月 22 日) -
1994 年膳食补充剂健康与教育法案:
Dietary Supplement Health and Education Act of 1994 (PL 103-417)(1994 年 10 月 25 日) -
1996 年 FDA 出口改革和促进法案:
FDA Export Reform and Enhancement Act of 1996(PL 104-134)(1996 年 4 月 26 日) -
1996 年食品质量保护法案:
Food Quality Protection Act of 1996(PL 104-170)(1996 年 8 月 3 日) -
1996 年动物药品供应法案:
Animal Drug Availability Act of 1996(PL 104-250)(1996 年 10 月 9 日) -
1997 年食品药品现代化法案(FDAMA):
Food and Drug Modernization Act of 1997(PL 105-115)(1997 年 11 月 21 日) -
2002 年儿童最佳药品法案:
Best Pharmaceutical for Children Act(PL 107-109)(2002 年 1 月 4 日) -
2002 年医疗器械用户费用和现代化法案(MDUFMA):
Medical Device User fee and Modernization Act of 2002(PL 107-250)(2002 年 10 月 26 日) -
2003 年动物药品用户费用法案:
Animal Drug User Fee Act of 2003(PL 108-130)(2003 年 11 月 18 日) -
2003 年儿科研究公平法案:
Pediatric Research Equity Act of 2003(PL 108-155)(2003 年 12 月 3 日) -
2004 年小型用途和小型物种动物健康法案:
Minor Use and Minor Species Animal Health Act of 2004(PL 108-282)(2004 年 8 月 2 日) -
2006 年膳食补充剂和非处方药消费者保护法案:
Dietary Supplement and Nonprescription Drug Consumer Protection Act(PL 109-462)(2006 年 12 月 22 日) -
2007 年 FDA 修正法案(FDAAA):
Food and Drug Administration Amendments Act of 2007(PL 110-85)(2007 年 9 月 27 日) -
2009 年生物制品价格竞争与创新法案(BPCI):
Biologics Price Competition and Innovation Act of 2009(PL 111-148, Title VII, Subtitle A) -
2009 年家庭吸烟预防和烟草控制法案:
Family Smoking Prevention and Tobacco Control Act(PL 111-31)(2009 年 6 月 22 日) -
2010 年菜单标签法案:
Menu Labeling(PL 111-148,Section 420) -
2011 年 FDA 食品安全现代化法案:
FDA Food Safety Modernization Act(PL 111-353)(2011 年 1 月 4 日) -
2013 年药品质量和安全法案:
Drug Quality and Security Act(PL 113-54) -
2014 年防晒产品创新法案:
Sunscreen Innovation Act(PL 113-195) -
2016 年 21 世纪治愈法案:
21st Century Cures Act(PL 115-52) -
2017 年 FDA 再授权法案(FDARA):
FDA Reauthorization Act of 2017(PL 115-52)
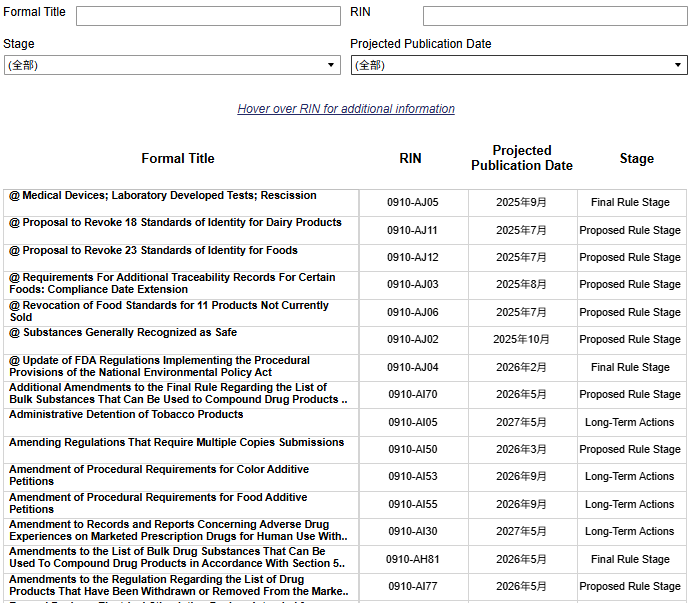
FDA 统一法规议程(Unified Agenda of Regulations)
美国联邦政府通常在春季和秋季于《联邦公报》上发布半年一次的法规议程。

文章为作者独立观点,不代表DLZ123立场。如有侵权,请联系我们。( 版权为作者所有,如需转载,请联系作者 )

网站运营至今,离不开小伙伴们的支持。 为了给小伙伴们提供一个互相交流的平台和资源的对接,特地开通了独立站交流群。
群里有不少运营大神,不时会分享一些运营技巧,更有一些资源收藏爱好者不时分享一些优质的学习资料。
现在可以扫码进群,备注【加群】。 ( 群完全免费,不广告不卖课!)







发表评论 取消回复