美国《联邦食品、药品和化妆品法案》(FD&C Act)(The Federal Food, Drug and Cosmetic Act)授权美国食品药品监督管理局 FDA 扣留并拒绝任何涉嫌违反 FDA 法律法规的受监管产品(Regulated product)。被拒绝的货物(Refused shipment)必须在 FDA 行动通知(拒绝通知)(Refusal Notice)发出之日起 90 天内,在 CBP 和 FDA 的监督下进行销毁或出口。FD&C Act 法案第 801 条规定了 FDA 监管的产品的进出口要求。
FDA 进口流程(FDA Import Process)
向 CBP 提交的受 FDA 监管产品的 Entry,也将以电子方式转交给 FDA 进行审核。
被视为高风险的产品和信息不完整或不准确的 Entry 将被标记,由 FDA 进行人工审查(Manual review),以确定该产品的可接受性(Admissibility)。 FDA 的筛查工具(Screening tool)使用各种信息来源来评估风险,例如,企业之前的合规历史或某种产品的已知合规问题。 FDA 的 Entry 审查人员使用各种信息来源来确定可接受性(Admissibility),例如,使用 FDA 的注册数据库来核实申报的药品或医疗器械产品制造商是否符合机构注册要求。 FDA 的 Entry 审查人员会在提交的 Entry 中寻找完整和准确的数据。向 FDA 提供完整、准确的数据可加快对你的 Entry 的审查。 -
进口物品在 FDA 确定可接受性之前不得上市销售(Distributed into commerce)。
检查和样本采集(Examination & Sample Collection)
FDA 有权进行检查和/或样品采集(Examinations and/or sample collections),以确定进口产品是否符合 FDA 法规和法律。作为 Entry 审查流程(Entry review process)的一部分,FDA Entry 审查人员指定 Entry 进行检查。检查(Examination)可能包括现场检查(Field examination)、标签检查和/或样品采集的任意组合。
什么是标签检查(Label examination)?
标签检查是对产品标签或标识的审查,以确定其是否符合标签要求。
什么是现场检查(Field examination)?
现场检查是对产品进行的实物检查(Physical inspection)。根据现场检查结果,FDA 可能会决定对产品进行抽样并将其送至 FDA 实验室进行分析,将产品交由当地 FDA 进口部门的合规部门进行进一步评估,或者如果没有发现违规行为,则放行产品。
检查(Examination)可以在不同地点进行,例如:国际邮政设施、仓库、边境入境点、卡车、火车和集装箱。
现场检查可以确定以下事项:
观察到的数量与装箱单上申报的数量不符 运输或储存过程中损坏 储存温度条件不足 啮齿动物或昆虫活动 陶瓷器皿中铅含量的现场测试 未经许可的食品和色素添加剂 产品完整性、异常气味或变质 其他可疑情况/做法 -
一般标签合规性
什么是样品采集(Sample collection)?
FDA 定期采集进口产品的样品,以确定产品是否符合公共卫生标准。为实现这一目标,FDA 可能会采集你进口产品的一部分并将其送至 FDA 实验室进行分析。FDA 调查人员(FDA investigators)接受过采样策略和技术方面的培训,以便收集代表进口产品的样品,并支持最终的可接纳性裁定(Final admissibility determination)。
为什么我的产品被选中进行检查/采样(Examination/sampling)?
以下是 FDA 进行实物检查或采集样品(Physical examination or collect a sample)的几个原因:
与产品相关的风险 产品历史记录(过去的违规行为) 制造商、托运人、进口商历史记录(过去的违规行为) -
例行监控(Routine surveillance)
如果我的产品将被检查和/或采样(Examined and/or sampled),FDA 将如何通知我?
当 FDA 决定检查或采集样品时,将向申报人(Filer)、进口商(Importer)、所有者(Owner)和/或收货人(Consignee)提供 FDA 行动通知(Notice of FDA Action)。
FDA 行动通知(Notice of FDA Action):
告知该 Entry 将被扣留以接受 FDA 检查或抽样;并且 -
指定 Entry 中需要扣留的物品(行项)(Items (lines))
FDA 行动通知还标明了具体信息,例如入境编号(Entry number)、当前状态、货物被扣留的原因、你应采取的措施以及就你的 Entry 与谁联系。
在 FDA 做出受理决定(Makes an admissibility decision)之前,我可以将产品移离入境口岸(Port of entry)吗?
在 FDA 做出受理决定之前,并无明确要求产品必须存放在入境口岸或附近。但是,FDA 期望 Entry 处理流程是在申报的入境口岸区域内进行。因此,如果 FDA 决定进行实物检查或采集样本,而产品已被移离入境口岸区域,则 FDA 可能会要求海关和边境保护局 CBP 发出重新交付要求(Issue a demand for redelivery),将产品送回入境口岸。
我可否在 FDA 进行检查前分销(Distribute)部分产品?
如果 FDA 发现在发出 FDA 行动通知(Notice of FDA Action)后未扣留有关产品或其部分,和/或进口商无视该通知,FDA 可能会要求 CBP 发出重新交付要求(Demand for redelivery),这意味着必须将有关产品送回入境口岸(Port of entry)。如果分销的产品没有送回(Returned) CBP 进行 FDA 检查或样品采集,则可能会采取 Bond 行动(Bond action)。
如果我的 Entry 被 FDA 标记为要进行审查(Examination),我该如何验证其当前状态?
你可以在 FDA 的进口贸易辅助通信系统 ITACS(Import Trade Auxiliary Communication System)页面上使用你的入境编号(Entry number)来检查 Entry 状态。
以下是你可能在 ITACS 中看到的一些状态声明示例:
向 FDA 提交 Entry 文件(发票、提单、CBP entry 文件)(Invoice,B/L,CBP Entry Document) 准予通行,不用 FDA 审查(May Proceed Without FDA Examination) 所有 Lines 扣留 - 通知 FDA 检查地点(Hold All Lines - Notify FDA of Location for FDA Examination) -
指定 Lines 扣留 - 通知 FDA FDA 检查地点(Hold Designated Lines - Notify FDA of Location for FDA Examination)
在通知 FDA 我的商品可供检查(Examination)时,我需要提交哪些信息?
应通过 FDA 的 ITACS 系统或联系当地 FDA 进口办公室,为每个入境编号(Each entry number)提交以下信息:
入境编号(Entry number) 提交人的姓名和联系信息 产品位置的完整地址 该地点的联系人姓名和电话号码 仓库/存储批次编号(如适用) -
营业时间(如果知道)
提交产品可用性信息(Product availability information)后会发生什么?
FDA 进口人员(FDA import personnel)将到产品所在地点进行检查和/或样品采集。
检查或采样(Examination or sampling)通常需要多长时间?
FDA 没有特定的法定或监管要求在规定时间内完成其受理流程。
检查或样品采集后会发生什么?我将如何收到通知?
采集样品后,FDA 将向备案进口商(Importer of record)、收货人(Consignee)和申报人(Filer)发出 FDA 行动通知(Notice of FDA Action)。该通知将提供样品采集的详细信息,包括对哪些产品进行了采样和采集的产品数量。
如果实物检查或分析结果表明产品似乎存在违规行为,FDA 将发出行动通知(扣留和听证通知)(Notice of Detention and Hearing)。产品将继续被扣留(Remain on hold),等待进一步的后续行动,最终决定产品是被拒绝或放行。
对于 FDA 未发现任何明显违规行为的产品,FDA 行动通知将表明该产品已获准放行。当前状态也将以电子方式传送给报关员(Entry filer)。
扣留和听证会(Detention & Hearing)
当你的货物中的产品违反或似乎违反 FDA 法律法规时,FDA 可能会扣留你的产品并发出标注为“扣留”(Detained)的 FDA 行动通知(Notice of FDA Action)。此通知被视为扣留和听证通知(Notice of Detention and Hearing)。
为什么我的产品被扣留(Detained)?
产品被扣留的原因可能是:
掺假(Adulterated),即产品受到污染、不安全或不符合适用标准; 误标(Misbranded),即标签包含虚假或误导性信息; 未经批准的新药; 在不卫生的条件下制造、加工或包装; -
在生产国或出口国被禁止或限制销售。
如果我的产品被扣留,我该怎么办?
如果 FDA 扣留了你的产品,你可以选择:
提交证据(也称为证词)(Testimony)以消除违规表象。 -
提交重新处理产品的请求(Request to recondition the product)以纠正违规行为。
如果你无法克服违规行为,你的产品将被拒绝入境,你可以与美国海关和边境保护局 CBP 以及 FDA 合作,在被拒绝入境后的 90 天内销毁产品或将其从美国出口。
我如何获知我的产品已被扣留?
FDA 通过发出“扣留和听证通知”(Notice of Detention and Hearing)通知责任方(Responsible parties),告知进口产品违反了 FDA 法律和法规。扣留和听证通知(Notice of Detention and Hearing)规定了进口商、所有者和/或收货人必须在“答复”日期之前向 FDA 提供证据(也称为证词),以消除违规表象。扣留和听证通知将提供似乎违反的法律和法规章节(Sections of the laws and regulations),这些被称为指控。
什么是“听证会”(Hearing)?
听证会(Hearing)是你提供证据(Evidence)或证词(Testimony)的机会,以消除违规行为的表象,并让 FDA 确信产品符合规定。听证会的形式多种多样,从一系列电子邮件或电话交谈到更正式的会议。听证官(The hearing officer)通常是扣留和听证通知(Notice of Detention and Hearing)上列出的 FDA 合规官(FDA compliance officer)。
什么是证词(Testimony)?
你有权向 FDA 提供口头或书面证词,说明有关产品的可接受性或使产品符合规定的方式。证词是你希望提交的任何信息,以消除违规行为的表象,或以其他方式支持你的产品放行。证词应提供给 FDA 行动通知(Notice of FDA Action)中列出的联系人,通常是合规专员(Compliance officer)。
你可以通过以下方式向 FDA 提供 Entry 文件(Entry documentation):
将文件上传至进口贸易辅助通信系统 ITACS(Import Trade Auxiliary Communication System)。ITACS 是向 FDA 提交文件的首选方法。这可以由进口商、报关行(报关员)(Entry filer) 或其他责任方完成;或 -
查找进口办公室联系页面来确定 FDA 当地进口部门的电子邮件地址、邮政地址和/或传真号码,以便在 ITACS 之外提交文件。
在适用的情况下,证词可能包括向 FDA 提交申请,请求允许使用 FDA 766 表格对不符合规定的物品重新贴标签或进行修复(Re-label or recondition non-compliant articles)。
扣留和听证通知(Notice of Detention and Hearing)上的“答复截止日期”(Respond by)是什么时候?
“答复截止日期”是提供证词的时间。FDA 的《监管程序手册》(Regulatory Procedures Manual)规定,自扣留之日起 10 个工作日内作出答复。为考虑到周末、节假日和邮寄时间,FDA 行动通知通常规定在通知上显示的扣留日期之后 20 个日历日(Calendar days)内回应。如果 FDA 在规定时间内未收到对扣留的答复,合规专员(compliance officer)可以发出拒绝入境通知(Refusal of admission)。
如果我需要更多时间对扣留做出回应怎么办?
如果在“扣留和听证通知”(Notice of Detention and Hearing)上指定的时间范围内提出延期申请,并且提供了合理的延期理由,你可以申请延期。如果请求获得批准,新的时间期限应在新的 FDA 行动通知(Notice of FDA Action)中明确说明。如果你对 Entry 的具体时间期限有疑问,请联系 FDA 行动通知上列出的合规专员(Compliance officer)。
谁负责回应扣留和听证通知(Notice of Detention and Hearing)?
货主或收货人(Owner or consignee)可以对 FDA 行动通知做出回应。除了收货人和货主之外,FDA 还允许备案进口商有资格向 FDA 提供有关货物(Shipment)的信息。备案进口商可能是报关行、收货人、所有者/货主或拥有装运货物 BOND 的一方。收货人、货主或备案进口商的指定代表可以代表收货人(进口商)出庭(Appear)或回应;但该代表必须获得收货人、所有者/货主或进口商的书面授权。
如果我没有回复会怎样?
如果 FDA 没有在 FDA 行动通知上列出的“答复截止日期”之前收到答复,合规专员可以发出拒绝入境通知(Refusal of admission)。通常,“答复截止日期”为 10 个工作日,但考虑到周末、节假日和邮寄时间,最多可达 20 个日历日。
如果我的产品被 FDA 扣留,可以移动吗?
在 FDA 作出可受理性决定之前,并没有明确要求将产品扣留在特定地点。然而,FDA 期望 Entry 处理流程在申报的入境口岸区域(Port of Entry area)内进行。因此,如果 FDA 决定进行实物检查或采集样品,而产品已被移离入境口岸区,FDA 可能会要求海关和边境保护局 CBP 发出重新交付要求(Demand for redelivery),将产品送回入境口岸(Port of entry)。
我被告知可以提交一份私人实验室报告(Private laboratory report)。我该怎么办?
根据违规行为性质,适用“无需实物检查的扣留” DWPE(Detention Without Physical Examination)的产品可由私人实验室进行采样检测,以提供证据消除违规行为的表象。若需更多时间完成私人实验室报告,可向 FDA 行动通知中列明的合规专员提交延期申请。
我收到的 FDA 行动通知表明我的产品可能被销毁。这是什么意思?
如果你的产品是通过国际邮件进口的药品或医疗器械,价值不超过 2,500 美元,并且你收到了 FDA 行动通知,表明该药品或医疗器械可能被销毁(Destruction),则 FDA 认定该药品或医疗器械产品违反法律,应予以拒绝并可能被销毁。
Entry 审查系统和工具(Entry Screening Systems and Tools)
进口 Entry 是如何进行筛查的?
自动化系统可帮助 FDA 工作人员加快对进口 Entry 的审查(Review),同时将 FDA 资源集中在风险最高的产品上。
这些系统以电子方式审核你的 Entry,并标记(Flag)有风险的产品或不完整或包含不准确数据的 Enrty。如果 Entry 的每一行项(Each line of an entry)都正确提交,则风险较低的产品可能无需进一步接受 FDA 审查即可进入美国国内商业市场(Enter domestic commerce)。
当系统标记某 Entry 的数据不完整或不准确时,FDA 审核人员可能会要求提供更多信息或要求进行实物检查或采样。
什么是 PREDICT?
基于风险的动态进口合规性目标预测评估 PREDICT(Predictive Risk- based Evaluation for Dynamic Import Compliance Targeting)是一种基于风险的分析工具,FDA 使用它来对进口或提供进口到美国的所有受监管货物以电子方式进行筛查。
PREDICT 改进了进口筛查和目标定位(Import screening and targeting),以防止掺假、误标或其他违规商品入境,并加快非违规商品的入境放行。PREDICT 利用自动数据挖掘(Automated data mining)、模式发现(Pattern discovery)和 FDA 数据库的自动查询来确定货物的潜在风险。它考虑了产品的固有风险以及有关进口商(Importers)、制造商(Manufacturers)和托运人(Shippers)的过往历史信息。
PREDICT 根据其分析结果对货物进行进一步审查。风险等级较低且没有其他潜在风险的货物可能比风险较高的货物更快地通过 FDA 审查。
我可以获得我的 PREDICT 评分(PREDICT score)吗?
由于 PREDICT 是 FDA 进口计划的关键调查工具,因此 PREDICT 评分不会向报关行/报关员(Entry filers)、进口商或公众公布。
什么是进口 Entry 审查系统(Import Entry Review System)?
进口 Entry 审查系统是 FDA 内部使用的应用程序(FDA application),用于查看 Entry 或申报行项(Line)文件、做出初步的 Entry 受理决定以及创建现场工作任务(Field work assignments)。该应用程序使 FDA 工作人员能够以高效的方式有效处理 Entry。
该应用程序具有附加功能(Added functionality),当 Entry 或申报行项 Line 中传输的信息不足以做出可受理决定时(Admissibility decision),可以快速向报关行(Customs broker)/报关员(Entry filer)请求提供更多具体信息。报关行/报关员可以通过进口贸易辅助通信系统 ITACS 上传所要求的文件,这些文件可在进口 Entry 审查系统(Import Entry Review System)中查看。有了补充信息(Additional information),FDA 的 Entry 审查人员可以根据需要更新数据并使用新数据重新筛选 Entry line。然后,Entry 审查人员可以发出“May Proceed”或设置工作任务(Setup a work assignment)。
进口 FDA 监管产品的修复(Reconditioning of Imported FDA-Regulated Products)
当产品因违反 FDA 法律法规而被扣留时,备案进口商可以向 FDA 提交申请,请求允许重新贴标签(Re-label)或修复产品(Recondition the product),以使其符合规定。
FDA 有权批准或拒绝修复申请(Application to recondition)。
修复过程的步骤(Steps for the reconditioning process)
提交 FDA 766 表格(Form FDA 766)
谁应提交 FDA 766 表格?
备案进口商(持有 Bond 的一方)(Person holding the bond)应填写 FDA 766 表格并提交给 FDA 行动通知中列出的合规官。
FDA 766 表格中应包含哪些内容?
FDA 766 表格应包括完成修复的预计时间,以及如何使产品符合规定的详细摘要。如果你的修复提案(Reconditioning proposal )包含新标签,请在提案中附上此标签的副本。
应如何向 FDA 提交 FDA 766 表格?
可以通过以下方式向 FDA 提供 Entry 文件(Entry documentation),包括 FDA 766 表格:
将文件上传至进口贸易辅助通信系统 ITACS(Import Trade Auxiliary Communication System)。ITACS 是向 FDA 提交文件的首选方法。这可以由进口商、报关行(申报人)(Entry filer)或其他责任方完成;或 -
使用“查找进口办公室联系页面”确定当地 FDA 进口部门的电子邮件地址、邮政地址和/或传真号码,以便在 ITACS 之外提交文件。
FDA 对你提案的审查(FDA’s review of your proposal)
FDA 合规专员(FDA compliance officer)将审查拟议的修复计划是否充分。如有必要,合规专员会将申请发送给 FDA 中心之一的专业领域专家(Subject matter expert),审查该提案并决定批准或拒绝该提案(Proposal)。
FDA 为何拒绝我的申请?
如果拟议的修复措施不能让 FDA 确信产品符合规定,FDA 可能会拒绝该申请。拒绝的原因可能包括但不限于:
修复申请未能证明其将纠正违规行为。 提交第二份修复申请,但未对修复操作(Reconditioning operation)进行有意义的更改。 提交第三份修复申请。 缺乏信息,包括修复后的标签、修复过程描述等。申请应提供法规规定的所有信息。 FDA 申请中心根据中心审查结果拒绝修复提案(Reconditioning proposal)。 -
FDA 政策或法规禁止拟议的修复操作。例如,修复因未经批准的新药指控而被扣留的产品。
如果你的申请被拒绝,合规专员将发出一份 FDA 行动通知,表明申请被拒绝。该通知将告知你是否可以提交另一份申请。
完成修复(Completion of reconditioning)
如果 FDA 批准你的修复申请(Reconditioning application),则必须在指定时间内完成修复。完成后,你必须通知 FDA 产品可供检查。
修复验证(Verification of reconditioning)
修复验证由 FDA 执行,费用由进口商承担,以便 FDA 验证修复过程是否已成功完成。
一旦 FDA 调查员(FDA investigator)验证了修复,如果修复成功,你的产品将被放行。如果检查发现修复不成功,你的产品可能会被拒绝入境(Refused)。
如果修复不成功,我是否可以再次提交修复申请(Reconditioning application)?
如果修复不成功,你可以根据需要提交第二份申请。通常情况下,除非该申请对修复操作进行了有意义的更改以确保修复成功的可能性合理,否则通常不会批准此申请。如果第二份申请只是重新提交原始申请,则不会获得批准。
第三次尝试修复的请求通常不会被批准。FDA 认为,允许无限制的重新修复请求只会鼓励进口商将违规商品进口到美国。如果此前该 Entry 的重新修复请求曾多次被拒绝,则可能会发出针对该 Entry 的拒绝入境通知。
如果我无法成功修复整批货物(Recondition the entire shipment),会发生什么情况?
如果部分货物成功修复(Successfully reconditioned),FDA 可能会发出部分放行/部分拒绝通知(Issue a partial release/partial refusal)。你将收到一份 FDA 行动通知(Notice of FDA Action),其中将标明货物中已成功修复的部分,以便可以放行。FDA 行动通知还将标明货物中未合规并被拒绝入境的部分。
监管费用(Supervisory Charges)
提交 FDA 766 表格时,你同意根据现行法规支付所有监管费用(Supervisory costs)。这些费用包括但不限于:FDA 监管官员的差旅费;FDA 监管官员离开其本职岗位时的每日津贴;FDA 监管官员的服务费用;以及必要时 FDA 分析师的服务费用。
你将收到 CBP 的指示,告知你如何支付与验证修复相关的费用。
关于产品修复事宜,应联系谁?
请联系 FDA 行动通知中列出的 FDA 合规专员(FDA compliance officer)。
进口拒绝(Import Refusals)
什么是 FDA 进口拒绝(Import Refusals)?
Refusal 是 FDA 的最终决定(Final decision),即被扣留的货物(Detained shipment)违反 FDA 的法规和条例。被拒绝的货物必须在 FDA 行动通知(拒绝通知)(Notice of FDA Action (Refusal Notice))发出之日起 90 天内销毁或在美国海关和边境保护局 CBP 和 FDA 的监督下从美国出口。
产品可能被拒绝的原因示例:
你未在规定的十个工作日内对 FDA 扣留和听证通知(FDA Notice of Detention and Hearing)作出答复,并且未请求和/或批准延长答复时间。 你提供了证据证明产品符合规定,但 FDA 认定所提供的证据无法消除违规表象(Did not overcome the appearance of a violation)(示例:你的产品被列入进口预警(Import alert)名单,需提供私人实验室分析报告证明产品未违规。你需提交了私人实验室报告,但 FDA 认定该实验室未遵循科学规程,因此该报告无效)。 你已提交了一份对产品进行修复(Recondition)的提案(表格 FDA 766),但该提案被拒绝,因为 FDA 无法确信其能够使产品符合规定(示例:你的产品被发现含有沙门氏菌。你提议对产品进行消毒。FDA 因消毒步骤不充分而拒绝了你的提案)。 你已提交了两份单独的提案(Proposals),请求修复掺假或贴错标签的产品,但两次尝试均不足以使你的产品符合要求。第三次修复请求通常不会获得批准,并将发出拒绝入境通知(Notice of Refusal of Admission)(示例:你的产品存在标签违规问题,第二次修复产品的尝试不足以使产品符合要求,因为修改后的标签(Revised labeling)上仍发现存在标签缺陷(Labeling deficiencies))。 -
你的被扣留货物的一部分已根据已获批准的申请(FDA-766 表)进行了重新处理。FDA 同意将货物剩余的拒绝部分出口或销毁。已针对被拒部分发出了拒绝入境通知。
我将如何收到拒绝进口通知(Refusal)?
FDA 将始终向备案进口商 IOR(Importer of record)发出拒绝入境通知(Notice of Refusal of Admission)。当地 FDA(Local FDA)的做法可能还包括向报关行(Broker)和收货人发送(Consignee)副本。FDA 还会将拒绝通知通知 CBP。
关于被扣留或拒绝入境的问题,请联系 FDA 行动通知 NOA(Notice of FDA Action)末页所列的合规专员(Compliance officer)。NOA 可通过 FDA 进口贸易和辅助通信系统 ITACS 系统(需持有 ITACS 账户)获取。
如果我的产品被拒绝,我有哪些选择?
当收到拒绝入境通知时,进口商有以下选择:
在 FDA 和 CBP 的监督下销毁(Destroy)产品。 -
在 FDA 和 CBP 的监督下出口(Export)产品。
如果我需要销毁或出口我的产品,我该联系谁?
你将收到当地 CBP 办事处的指示。你必须在拒绝后的 90 天内出口或销毁产品。如果 FDA 要见证出口或销毁,你应该联系 FDA 行动通知中注明的 FDA 合规专员(Notice of FDA Action)。
如果我没有在 90 天内出口或销毁产品,会发生什么情况?
当 FDA 发出拒绝入境通知时,CBP 会收到通知,并要求你将产品重新交付到入境口岸的 CBP 批准地点。通知给你 90 天的时间退回产品。如果你未能履行此义务,CBP 可能会根据 BOND 评估违约赔偿金(Liquidated damages)。
我可以向 FDA 申请超过 90 天的延期吗?
不可以,FDA 无权批准此类延期。有关延长 90 天期限的问题,你可以联系当地 CBP 办事处。
我可以对拒绝决定提出上诉吗?
拒绝进口(Refusal)是最终决定(Final decision)。除非 FDA 错误地发出了拒绝,否则不会考虑撤销拒绝的请求。
在哪里可以找到 FDA 拒绝进口的清单?
进口拒绝报告 IRR(Import refusals report)根据行业代码提供按国家/地区和产品分类的拒绝进口清单(List of refusals)。IRR 每月更新一次。FDA 制定 IRR 的目的是向公众提供有关似乎违反 FDA 法律法规的货物(Shipments)的信息。
Entry 提交(Entry Submission)
受 FDA 监管的产品在进口美国时须接受 FDA 的审查(Review)。FDA 会以电子方式审查通过美国海关和边境保护局 CBP 提交的所有受 FDA 监管的进口产品的 Entry。进口到美国的受 FDA 监管的产品必须符合 FDA 的所有法律和法规。不符合要求的产品将被拒绝入境。
如何提交 FDA 监管产品的 Entry?
任何进口流程的第一步都是从美国海关和边境保护局 CBP 开始。
要将产品进口到美国,你可以与报关行(Entry 申报人)(Entry filer)签订服务合同。报关行(Customs broker)是美国关税法授权的唯一有权代表进口商处理海关事务的代理人。报关行是获得 CBP 许可的个人或公司,负责准备和提交必要的海关报关文件(Customs entries),安排支付关税,并在其他海关事务中代表委托人行事等。
向 CBP 报关时,进口商或其报关行将在 Entry 中列明协调关税表 (HTS) 代码及其他申报内容。HTS 代码带有指示符(FD 标记,指 FDA 标记),以帮助指导是否需要提供 FDA 数据。
协调关税表(Harmonized Tariff Schedule)(HTS 或 HTS 代码)是一种分类代码(Classification code),用于为所有进口到美国的商品(Merchandise)提供适用的关税税率(Tariff rates)和统计类别(Statistical categories)。它基于国际协调体系(International Harmonized System),该体系是用于描述大多数世界商品的全球分类系统。要确定你的 HTS 代码(HTS code),请在美国国际贸易委员会(US International Trade Commission) HTS 页面上搜索。
你的产品的 HTS 代码很可能与 FD 标记(FD flag)相关联。此 Flag 可向报关行指示你的产品需要传输给(Transmitted to) FDA 进行审查(Review)。但并非所有 HTS 代码都有 FD 标记(FD flag);例如,不受 FDA 监管的产品(如纺织品)就没有 FD 标记(FD flag)。这并不意味着该产品不受 FDA 监管。海关报关行/申报人(Customs brokers/entry filers)根据其对产品预期用途的了解,仍可为没有 FD 标记(FD flag)的 HTS 代码传输 FDA 数据。
下表显示了 FD 标记(FD flags)列表和一些示例:
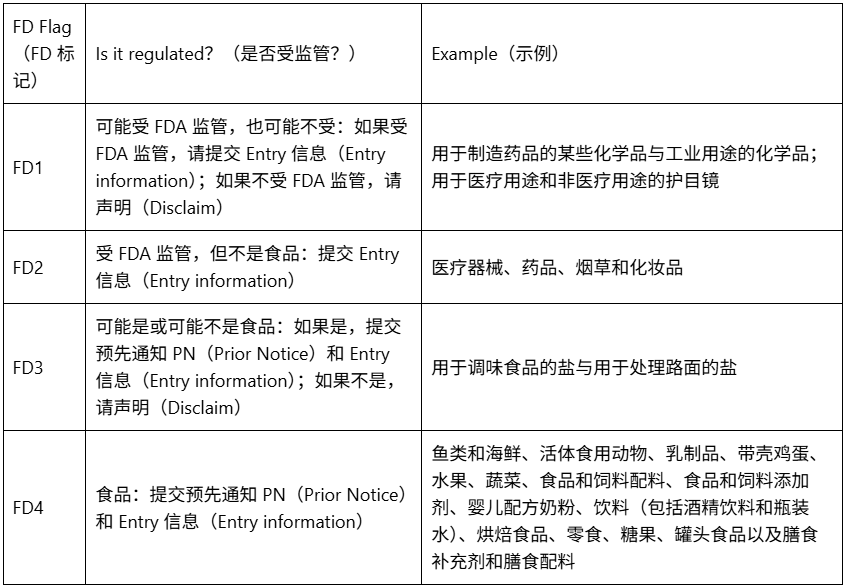
当 HTS 代码表明该产品受 FDA 监管时,需要向 FDA 提交信息:
电子提交(Electronic submissions):使用电子系统的报关行将被提示向 FDA 提供以下信息(除了向 CBP 提供的电子信息外)
商品和子类(Commodity and subtype) 产品代码(Product code) 产品描述(Product description) 标识产品的生产地、来源地、种植地或收获地的国家代码(Country code) 制造商、托运人、进口商、收货方的名称和地址 联系信息(Contact information) 预计抵达日期和时间(抵达日期前 5 天 Entry 才会传输至 FDA 进行审查) FDA 合规声明(FDA Affirmation of Compliance)(某些情况下必须提供)(Mandatory in some instances) 数量及价值(自愿提交)(Voluntary submission) -
某些产品可能需要附加数据元素(Additional data elements)
手动(纸质)提交(Manual (paper) submissions):未使用电子系统的进口商/报关行将被要求向当地 FDA 进口办事处(Local FDA Import office)提供其 Entry 文件(Entry documentation)以供审查(Review)。
无论 Entry 信息是通过电子系统还是人工流程提交给 FDA,FDA 都会使用现有信息来确定所提供进口物品的可接受性。
如果我的 HTS 代码没有关联的 FD 标记(FD flag),但我认为进口产品受 FDA 监管,该怎么办?
并非所有 HTS 代码都有 FD 标记。这并不意味着产品不受 FDA 监管。根据产品的预期用途(Intended use of the product),报关行仍为没有 FD 标记的 HTS 代码传输 FDA 数据。
在提交 Entry 申报(Entry submission process)过程中,报关行(Entry 申报人)可以为你提供哪些帮助?
确定你的产品是否受 FDA 监管。 确定符合 CBP 要求的协调关税表 HTS 代码(Harmonized Tariff Schedule codes)。 告知进口商 FDA 要求的信息及相关合规声明(Affirmations of compliance)。 获得足以支付 Entry 费用的 Bond(Obtain a bond sufficient to cover the entry)。 向 FDA 提供所需文件,例如政府表格、发票和证明(进口商可能需要向报关行提供这些文件)。 使用自动化报关行接口 ABI(Automated Broker Interface)将所需的 FDA entry 信息(FDA entry information)通过 CBP 的电子进口处理系统传输至 FDA 的电子进口处理系统。 输入产品的合规声明信息,以加快 FDA 审查。 进口商需要向报关行提供合规声明信息,如注册号。 通过 FDA 的 ITACS 系统或其他方式向 FDA 提供初始文件或所需的文件。 -
以电子方式提交预先通知 PN(Prior Notice)。
我如何才能加快 FDA 对我的 Entry 的审查?
FDA 接收通知的最佳方式是通过其电子进口 Entry 审查系统(Electronic import entry review system)。通过该系统处理的 Entry 将根据 FDA 制定的标准进行电子筛选(Electronically screened)。
在入境申报时提交准确完整的信息,并及时回应对其他文件/信息的请求,有助于加快 Entry 审查过程(Entry review process)。注意:提交不准确或不完整的信息可能会延迟对你的 Entry 的审查。
传输所需信息(Transmitting Required Information)
当进口商或报关行向美国海关和边境保护局 CBP 提交 entry 时,协调关税表 HTS 代码会指示(Indicates)是否应将该 Entry 传输至(Transmitted to) FDA。对于受 FDA 监管的产品,需要提交特定信息。你可以通过最初提供准确完整的信息并快速响应 FDA 要求提供更多文件或信息的请求来帮助 FDA 加快对你进口产品的审查。
补充信息(Additional Information):
FDA 使用入境编号(Entry number)来识别和追踪你的货物(Shipment)。每个报关行都有一个指定的 3 位数申报人代码(3-digit filer code),该代码由字母和/或数字组成。报关行提交的每个 Entry number 都以其指定的 3 位申报人代码开头,并在申报人代码后包含额外的 8 位数字(即 xxx-xxxxxxx-x)。 按照 FDA 要求及时提交 Entry 文件有助于加快货物转运。FDA entry 审查人员(FDA entry reviewers)可能会通过 Entry 文件(entry documents)收集更多信息,或将传输的信息/数据与产品发票或其他进口 Entry 文件(Import entry documents)进行比较,以确定传输至 FDA 的信息/数据(Information/data)是否准确。 使用 FEI 门户(FEI Portal)根据公司名称和地址查找 FDA 企业标识符 FEI 或验证 FEI 的地址。 FDA 鼓励进口商或 Entry 申报人在 ITACS 系统中上传 Entry 文件(Upload entry documents),以便 FDA 的 entry 审查人员在以电子方式审查你的 Entry 时可以参考这些文件。 -
对于食品和饲料产品(Food and feed products),必须以电子方式将事先通知 PN(Prior Notice)信息传输给 FDA。
合规性声明代码(Affirmation of Compliance Codes)
所有受 FDA 监管的产品在进口至美国时均需符合规定。为了帮助加快 FDA 对产品合规性的审查,Entry 申报人(Entry filer)可以在提交 Entry 申报时提交其他信息,例如注册号、登记号(Listing)和批准号。可以使用合规性确认代码(A of C 代码)提交这些信息。
通过使用 A of C 代码,Entry 申报人确认 FDA 行项(FDA line)中标识的公司和/或产品符合每个代码的特定要求。根据你进口的产品,提交某些 A of C 代码可能是强制性的。除了所有强制性 A of C 代码外,自愿提交 A of C 代码可能会加快对 Entry 的初步筛选和进一步审查(Initial screening and further review of an entry)。
制造商或进口商等责任方应能说明何时应使用这些申明,并在需要时提供限定符(Qualifier)。
A of C 限定符(Qualifiers)提供产品和制造商的具体信息。FDA 使用这些信息来验证产品是否合规。有些申明(Affirmations)需要提供产品制造商的注册号(工厂独有)或产品批准号(产品独有)。
Entry 审查(Entry Review)
所有进口的 FDA 监管产品均由 FDA 审查,FDA 决定产品是否允许进入美国商业市场(U.S. commerce),并可拒绝任何违反或看似违反 FDA 法律法规的产品入境。所有受 FDA 监管的进口产品的 Entry 均由 FDA 的电子系统审查,对提供进口的 FDA 监管产品的初始电子审查是“Entry 审查”(Entry Review)流程的第一步;进一步的审查由 FDA 员工(通常称为 Entry 审查员)(Entry reviewers)进行。
2025 更新:FDA 已经对其进口监管能力进行了重大升级,包括全国统一 Entry 审查计划 NER(Nationalized Entry Review Program)和先进的 Entry 审查与进口操作系统 SERIO+(System for Entry Review and Import Operations),旨在更快地查获不安全产品,增强 FDA 保护美国家庭的能力。
全国统一 Entry 审查计划 NER
FDA 已实施全国统一 Entry 审查计划 NER(Nationalized Entry Review Program)以应对因电子商务增长、贸易量扩大及供应链复杂化所导致的 FDA 监管进口商品激增问题(自 2025 年 8 月 4 日起生效),该计划将 FDA 对全美进口产品的审查工作集中管理。主要特点包括:
-
协调一致的全国性应对措施(Coordinated National Response):
取代各入境口岸分别对特定 Entry 进行人工审查的做法,专家团队在全美范围内协调行动,以更快速地识别并拦截危险产品。 -
协调实时预警系统(Harmonized Real-Time Alert System):
当 FDA 在某一入境口岸发现高风险产品时,比如受污染的婴儿配方奶粉或假药,所有其他入境口岸都会立即收到警报,注意类似的危险产品。 -
提高效率(Enhanced Efficiency):
NER 基于 2022 年成功的试点项目,该项目使处理速度提升 70%,并额外识别出 36% 的高风险产品进行进一步检测。 -
提升审查员的可用性(Increased Reviewer Availability):
该计划使 FDA 审查员在全国网络中的可用性更高,并促进了跨区域协作。
Entry 审查流程(Entry Review Process)
对于大多数货物,进口流程(Importation process)的第一步是向 CBP 提交 Entry 信息(Entry information)。在以电子方式向海关和边境保护局 CBP 提交 Entry 后,如果货物中包含受 FDA 监管的产品,CBP 会根据海关入境编号(Entry number)(格式为 XXX-XXXXXXX-X)将有关这些产品的数据发送给 FDA 进行审查。
当 FDA 系统收到你的 Entry 信息(Entry information)时,会对其进行电子筛查。发送给 FDA 的有关 FDA 监管产品的所有电子数据均由 FDA 系统进行筛查。以完整、准确和有效数据传输的产品可能会获得较低的风险评分(Lower risk),则可能会无需 FDA 人工审查即可获准放行。
任何未获得 FDA 系统放行的 Entry 都将转至 FDA 全国统一 Entry 审查计划 NER 进行人工审查(Manual review)。可能发生这种情况的一些原因包括:
产品被认定为高风险; Entry 不包含所有必要信息; 疑似被列入“无需事物检查的扣留”DWPE(Detention without Physical Examination)(或进口预警)的产品;以及 -
被确定需要进行检查或采样(Examination or sampling)的产品,无论是通过监测方式确定的,还是有针对性地选定。
NER 审查人员将评估提交的有关你产品的信息,以确定其可接受性(即放行或拒绝)。FDA entry 审查人员使用内部数据库来协助审查过程。
根据初始人工审查的结果,NER 审查人员可能会采取以下一项或多项措施:
产品放行(Release the product) 要求提供更多信息(Request additional information),可以通过:审查 Entry 文件(Entry documents)(所需文件);和/或检查/采集产品样品(Examination/sample collection of the product) -
要求扣留产品(Request detention of the product)
产品放行(Release of the product)
NER 审查人员可发出产品放行通知(Issue a release of the product)。这意味着产品可以在美国商业市场中流通。如果之后发现问题,放行通知并不妨碍 FDA 采取后续行动。
要求提供更多信息(Request for additional information)
有时电子 Entry(Electronic entry)中传输的数据不足以做出可受理性决定,或者似乎存在缺失、不准确或无效的数据,NER 审查人员可能会要求提供更多信息。
审查 Entry 文件(Review of entry documents)
如果需要更多信息来做出可受理性决定,Entry 审查人员(Entry reviewer)可能会要求提供 Entry 文件或要求提供与产品相关的具体信息。Entry 文件(Entry documents)通常包含有助于验证是否符合某些要求的信息,有助于验证电子数据中提交的信息,还可能包含可用于确定可受理性的的其他信息,例如产品标签、证书、成分表、加工记录、分析信息等的副本。
FDA 的进口贸易辅助通信系统 ITACS(Import Trade Auxiliary Communications System)允许以电子方式提交 Entry 文件(Entry documentation)和货物可用性信息(Goods availability information)。ITACS 是 FDA 接收 Entry 文件的首选方法。
产品检查/样品采集(Examination/sample collection of the product)
如果 FDA entry 审查人员无法根据电子数据或 Entry 文件核实可受理性,则可能需要对产品进行检查(Examination)。检查(Examination)可包括现场检查(Field examination)、标签检查和/或样品采集的任何组合。FDA 工作人员接受过检查和样品采集技术的培训;检查结果和所采集样品的分析结果将用于确定产品的可接受性(Admissibility of the product)。
要求扣留产品(Request detention of the product)
根据对 Entry 信息(Entry information)的审查,可能存在违规行为。这可能是由于产品和/或制造商受到无需实物检查的扣留 DWPE(Detention without physical examination)(也称为进口预警)(Import Alert)的约束,或者由于无法核实是否符合特定要求(例如,如果在 FDA 的药品注册数据库中找不到药品的申报制造商)。
在这些情况下,FDA 的 Entry 审查人员(FDA’s entry reviewers)可能会根据违规行为的表象要求扣留你的产品。Entry 审查人员会将扣留请求(Requests for detention)转发(Forward to)给 FDA 合规部门(FDA Compliance Branch)进行进一步审查。
Entry 审查系统(Entry Review Systems)
NER 审查人员利用 SERIO+ Entry 审查、PREDICT 和内部系统等应用程序来协助审查过程。随着 SERIO+ 的实施,这些工具将集成到一个更高效的单一平台中 - Entry 审查和进口操作系统(SERIO+)。
全面实施(Full Implementation):2026 年 3 月
FDA 正在通过用先进的 Entry 审查和进口作系统(SERIO+)替换其过时的进口审查平台(Import review platform)来实现其技术现代化。其优势包括:
集成平台(Integrated Platform):通过将多种工具和数据库集成到一个综合系统中,简化了 FDA 的进口审查流程。 更快访问(Faster Access):使检查员(Inspectors)能够更快地获取全面信息。 无缝集成 CBP(Seamless CBP Integration):新系统保持了与美国海关和边境保护局 CBP 系统的关键连接,使受 FDA 监管的产品能够快速进入审查流程。 -
提高效率(Improved Efficiency):使 FDA 工作人员能够更有效地更新信息和重新筛查产品,帮助确保在保持全面监管的同时更快地做出产品安全决策。
人工或“非电子”Entry 处理流程(Manual or “non-electronic” entry process)
未以电子方式提交的 Entry 将由 FDA 人工审查。无论是通过电子系统还是人工流程(Manual process)提交 Entry,FDA entry 审查人员的决策流程都是一样的。
所需文件状态(Documents Required Status)
FDA 通常会要求(Routinely requests)提供提交给 FDA 审查的 Entry 的文件。
我的 Entry 状态(Status of my entry)显示“需要文件”(Documents required)。这是什么意思?
如果需要更多信息来做出可受理性决定,FDA entry 审查人员(FDA entry reviewer)可能会将你的 Entry 状态设置为“需要文件”(Documents required)。这可能是由于提交的 Entry 信息(Entry information)不完整或不准确,或者你的产品似乎不合规。
我应该向 FDA 提供哪些文件?
你应向 FDA 提供 Entry 文件(Entry documentation),其中可能包括:提单 BOL(Bill of Lading)、航空运单 AWB(Airway Bill)、发票(Invoice)和采购订单(Purchase order)。
在适用的情况下,你还应向 FDA 提供商品特定认证(USDA 许可证、抗冲击性测试结果等)、装箱单/种植者清单(Growers list)、标签副本、说明实际制造商的文件、解释为什么归类为美国退货商品(U.S. Goods Returned)的物品被退回的文件、分析证书、预期用途声明或最终用途声明,以及要求的其他相关文件。对于人工(非 ABI )(Manual (Non-ABI) )Entry,还应向 FDA 提供 CBP 表格 3461 和/或 7501。
如果不确定需要提供哪些文件,请联系处理你的 Entry 的 FDA 当地办事处。
如何将文件提交给 FDA?
可以通过以下方式向 FDA 提供 Entry 文件:
将文件上传至进口贸易辅助通信系统 ITACS(Import Trade Auxiliary Communication System)。ITACS 是向 FDA 提交文件的首选方法。这可以由进口商、报关行(申报人)(Entry filer)或其他责任方完成;或 -
使用“查找进口办公室联系页面”确定当地 FDA 进口部门的电子邮件地址、邮政地址和/或传真号码,以便在 ITACS 之外提交文件。
如果我不向 FDA 提供文件会怎样?
若未能及时提供 Entry 文件,可能会导致你的 Entry 处理延迟。
如果我对提交文件有疑问,我应该联系谁?
你应该联系入境口岸的 FDA 当地办事处(Local FDA Import office)。
文章为作者独立观点,不代表DLZ123立场。如有侵权,请联系我们。( 版权为作者所有,如需转载,请联系作者 )

网站运营至今,离不开小伙伴们的支持。 为了给小伙伴们提供一个互相交流的平台和资源的对接,特地开通了独立站交流群。
群里有不少运营大神,不时会分享一些运营技巧,更有一些资源收藏爱好者不时分享一些优质的学习资料。
现在可以扫码进群,备注【加群】。 ( 群完全免费,不广告不卖课!)







发表评论 取消回复