美国食品药品监督管理局 FDA 监管约 7000 种不同的医疗器械产品,FDA 在医疗器械(Medical Devices)进口或拟进口至美国时,会验证并执行(Verifies and enforces)适用的医疗器械要求。FDA 根据医疗器械的分类及其风险程度,采用最少负担原则(Least burdensome approach)对医疗器械进行上市前审查(Premarket review),该审查基于对可靠的安全性与性能数据的全面评估,并采用全产品生命周期管理方法(Total product life cycle approach)。
CDRH 客户协作门户网站(CDRH Portal)
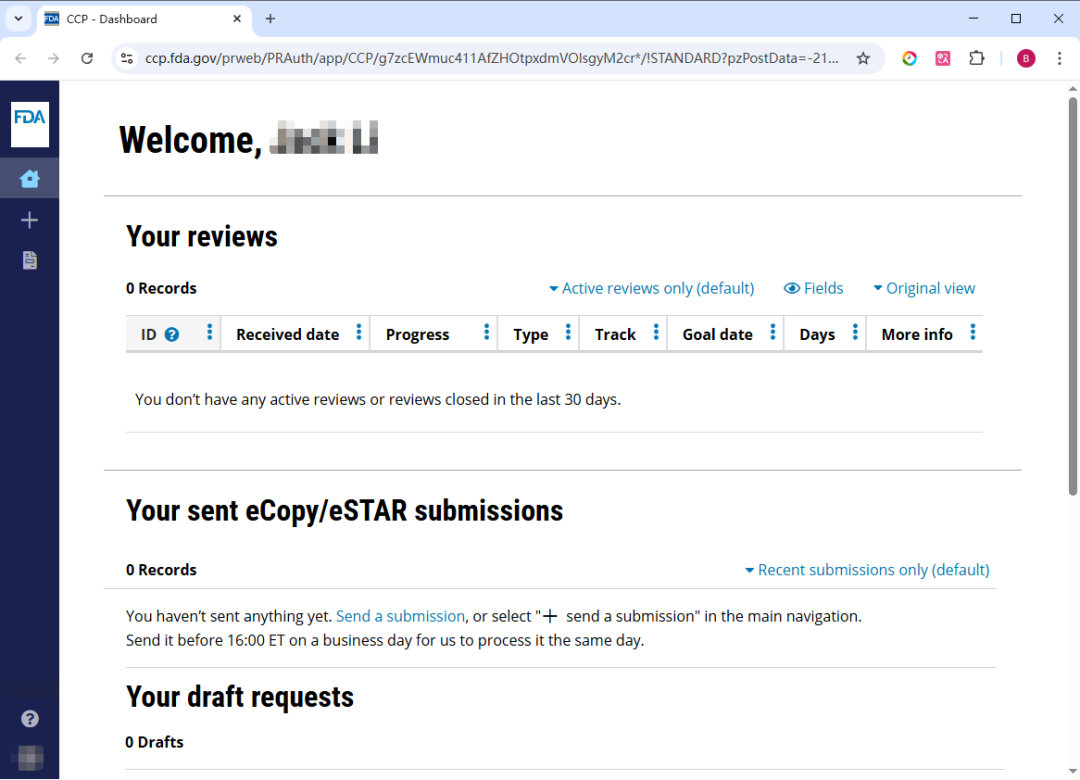
2022 年 10 月 3 日,FDA 宣布现在可以通过 CDRH 客户协作门户(Customer Collaboration Portal)网站“CDRH 门户”(CDRH Portal)在线提交 CDRH 电子副本 eCopy(Electronic copy)或电子提交模板与资源 eSTAR(Electronic Submission Template And Resource)上市前申报(Premarket submissions)文件。
FDA 创建并改进了CDRH 门户网站,以履行医疗器械用户收费修正案 MDUFA(Medical Device User Fee Amendments)IV 和 V 的规定。
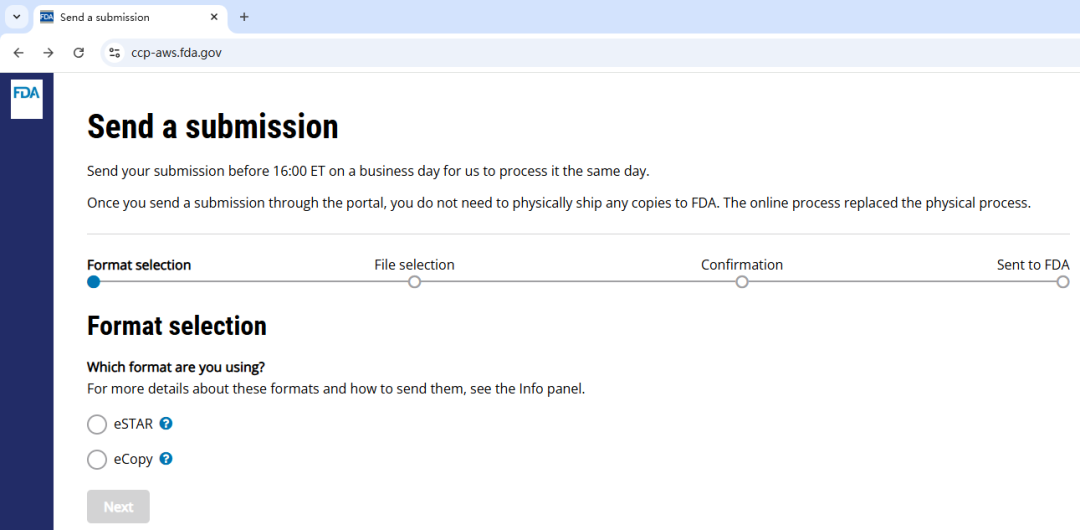
基于 2021 年推出的 510(k) 申报进度跟踪器(Progress tracker for 510(k) submissions)和 2022 年 7 月推出的电子上传试运行流程(Trial process of electronic uploads),注册 CDRH 门户(CDRH Portal)帐户后,即可在线提交 CDRH eCopy 或 eSTAR 上市前申报(Premarket submissions)文件。
CDRH 使用 Okta 进行身份验证(Identity verification)和单点登录(Single sign-on),用户注册 CDRH 门户帐户时,系统会使用 Okta 服务。帐户注册和密码重置请求将来自以 @okta.com 结尾的电子邮件。
CDRH 门户(CDRH Portal)为 CDRH 上市前申报(Premarket submissions)提供进度追踪(Progress tracking)和在线提交(Online submission)功能。在线进度追踪器(Online progress tracker)有一个仪表板(Dashboard),显示近乎实时的提交状态。
所有由 CDRH 主导的上市前申报类型(Premarket submission types)均可在审查流程的任何阶段上传至 CDRH 门户网站。官方联系人(Official correspondents)在将电子申报(Electronic submission)上传至 CDRH Portal 门户网站后,无需再向 FDA 发送纸质附函(Physical cover letter)。
自 2023 年 10 月 1 日起,所有 510(k) 申报(510(k) submissions)(除非获得豁免)都必须通过 CDRH 门户网站使用 eSTAR 以电子方式提交。 自 2024 年 11 月 1 日起,所有小型企业认定申请都必须使用 CDRH 门户网站提交。 -
自 2025 年 10 月 1 日起,所有 De Novo 提交(除非获得豁免)都必须通过 CDRH 门户网站使用 eSTAR 以电子方式提交。
IDEs,上市前咨询性提交(Pre-Sub submissions)以及某些 PMA 申请(PMA application)和补充申请(Supplement types)可自愿通过 CDRH 门户网站(CDRH Portal)以 eSTAR 提交,或邮寄至FDA。513(g) 信息请求可自愿通过 CDRH 门户网站以 eSTAR 提交,也可通过 CBER 的 ESG 在线提交,或邮寄至 FDA。
需要注意的是,CDRH 门户无法接收大于 4GB 的提交文件或附件大于 1GB 的 PDF 文件。
CDRH 门户网站:eCopy
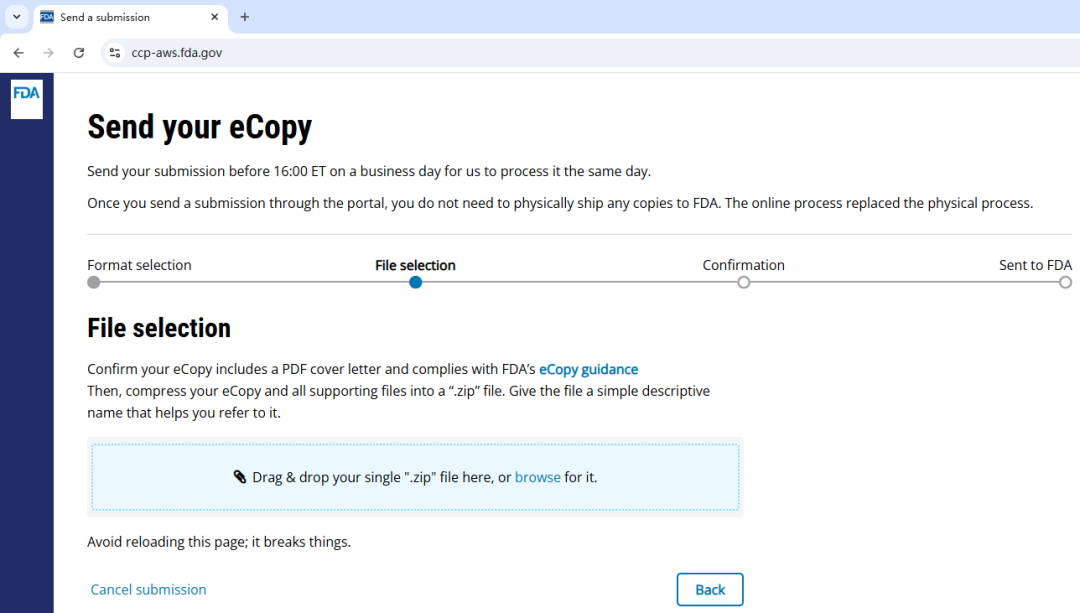
电子副本 eCopy(Electronic copy)是指以电子格式提交的医疗器械文件副本,与之前要求提交给 FDA 的纸质副本相同。
CDRH 门户网站:eSTAR
2020 年 2 月,美国食品药品监督管理局 FDA 启动了自愿性试点项目:电子提交模板和资源 eSTAR(electronic Submission Template And Resource)。
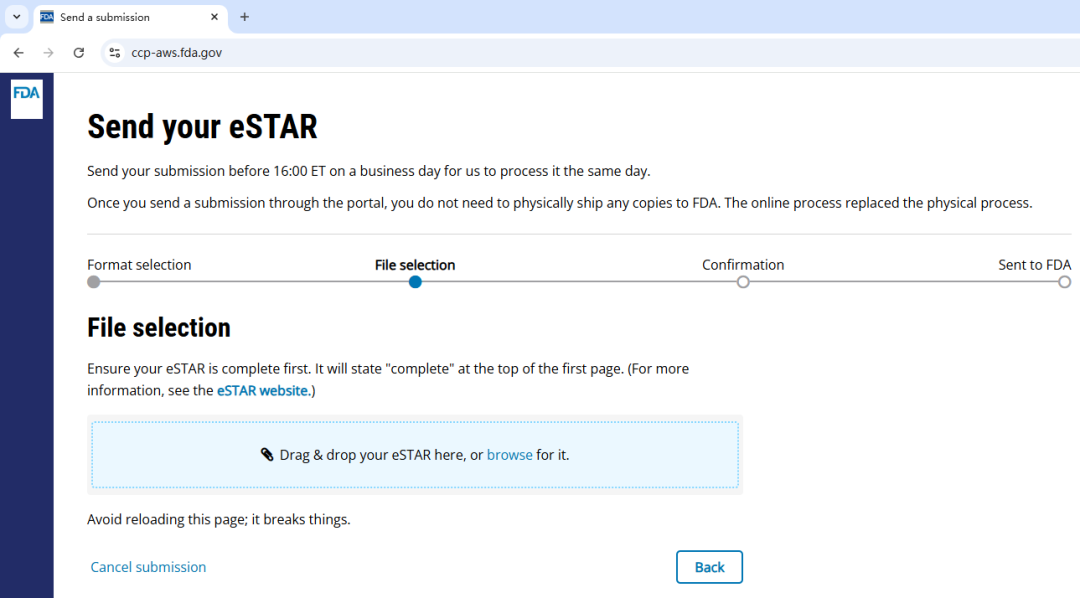
电子提交模板及资源 eSTAR(Electronic Submission Template And Resource)是一个交互式 PDF 表格(Interactive PDF form),医疗器械申报方可以使用该模版完成特定医疗器械的上市前提交材料的准备流程,使用此电子提交模板(Electronic submission template)创建的电子申报(Electronic submission)通常被称为 eSTAR。借助标准化的格式,申报方可以确保其申请材料完整无缺,FDA 也能更高效地开展上市前审查(Premarket reviews),从而促进安全、有效、高质量的医疗器械及时上市。
目前,除 510(k) 和 De Novo 外,所有 CDRH 提交类型(Submission types)均可自愿使用 eSTAR。
FDA 收到 eSTAR 提交(eSTAR submission)后,鉴于使用电子提交模板(Electronic submission template)正确准备的电子提交(Electronic submission)应视为完整提交(Complete submission),预计不会对 eSTAR 提交进行拒绝受理 RTA(Refuse to accept)程序。但是,FDA 计划对 eSTAR 提交实施病毒扫描(Virus scanning)和技术筛查(Technical screening)流程。
如果 eSTAR 未通过技术筛查(即,提供的 eSTAR 中没有任何附件与问题相关,或者对任何问题提供了不准确的回答),则该提交(Submission)可能会被提前搁置 180 天(置于待处理状态)进行技术审查,直至提交完整的替换 eSTAR 为止。
如果通过邮件提交的 eSTAR 不完整,FDA 将通过电子邮件通知提交人,并指出不完整的信息,并且该提交将被搁置 180 天(置于待处理状态),或直至向 FDA 提交完整的替换 eSTAR 为止。
文章为作者独立观点,不代表DLZ123立场。如有侵权,请联系我们。( 版权为作者所有,如需转载,请联系作者 )

网站运营至今,离不开小伙伴们的支持。 为了给小伙伴们提供一个互相交流的平台和资源的对接,特地开通了独立站交流群。
群里有不少运营大神,不时会分享一些运营技巧,更有一些资源收藏爱好者不时分享一些优质的学习资料。
现在可以扫码进群,备注【加群】。 ( 群完全免费,不广告不卖课!)







发表评论 取消回复